硬纤维瘤在临床中并不常见,但若真的遇到这样的病例,如果初始治疗不得当,后续治疗就会相当棘手。今天,我们就从 1 个典型病例入手,认真学习一下硬纤维瘤的处理。
病例快览
国外文献中有一篇很有意思的关于腹内硬纤维瘤手术后复发的成功治疗案例。
患者是一名 7 岁的小女孩。该患者在 出生后仅 11 个月大时曾因左侧肾母细胞瘤行手术治疗,之后每 6 个月随访一次。至患者 7 岁时,突然发现腹腔内一巨大肿块,活检提示硬纤维瘤。其后行腹腔镜下手术治疗,术中发现瘤体包绕回肠,但并没有将肠系膜根部完全包绕,在腹腔镜下将肿瘤及部分肠段成功切除。
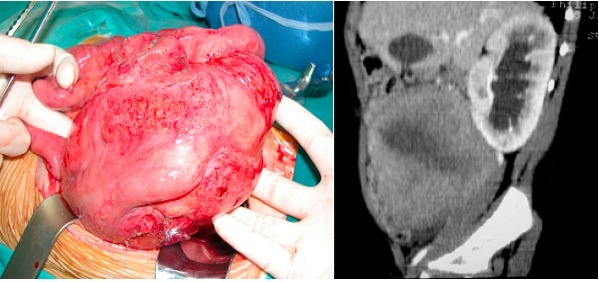
图片来源:Silvana Federici, et al. Journal of pediatric surgery, 2012.
术后肿块复发。在距第一次手术 6 个月后,行第二次腹腔镜肿块切除术。此后,该肿瘤复发并迅速增长至 83*33 mm。之后行低剂量 VBL+MTX 化疗,每周 1 次。化疗的最初 4 个月内,肿瘤增大至 90*60 mm。化疗 12 个月后,肿瘤开始缩小。化疗进行至 4 年 9 个月时,肿瘤消失并未再发。
这个病例体现了腹内硬纤维瘤的一些特点,如尝试性切除后复发率较高,复发后的肿瘤比初始肿瘤更具侵袭性。接下来,我们就来系统学习一下硬纤维瘤。
虽少见,却可成为致命并发症
硬纤维瘤(Desmoid tumor),也称侵袭性纤维瘤病(Aggressive fibromatosis),是一种少见的局部侵袭性肿瘤,在所有软组织肿瘤中占比约 3%。普通人群中的发病率约为每年每百万人口中 2~4 例。好发于 15~60 岁的人群,年轻人和老年人中则极少出现。女性患者较男性稍微更常见,没有显著的种族或民族倾向。
大多数硬纤维瘤为散发出现,但约有 5%~15% 的家族性腺瘤性息肉病(familial adenomatous polyposis, FAP)患者会伴发硬纤维瘤病,称为 Gardner 综合征。该病由 Gardner 于 1951 年首次报道。有文献报道,FAP 患者发生硬纤维瘤的风险比普通人群要高 852 倍,且高达 11% 的 FAP 患者在行早期结肠切除术后,因硬纤维瘤所致的并发症而死亡,这一点被大多数临床医师所不知。因此,在临床上如发现硬纤维瘤,应建议行肠镜筛查。
危险因素:手术、雌激素、创伤史
有研究发现,FAP 患者中的硬纤维瘤特别好发于手术部位 (如行结肠切除术后的肠系膜或腹壁,造瘘口或人工肛门部位),有明确的证据表明,手术是 FAP 患者并发硬纤维瘤的危险因素。在 FAP 合并腹部硬纤维瘤的患者中大约有 68% 之前进行过腹部手术,且约一半患者是在 FAP 手术后 5 年内出现病变。
有篇文献报道了一例患者,特别提示了该病变与手术的关联。该腹内硬纤维瘤患者先是接受了化疗,取得了一定的疗效,后来,诊疗医师为了明确疾病的治疗效果,对她进行了腹腔镜检查。几个月之内,3 个腹壁穿刺部位都开始出现硬纤维瘤,肿瘤变得巨大且不可手术,最终患者死亡。
硬纤维瘤与雌激素的水平也有一定的相关性。腹外和腹部硬纤维瘤好发于妊娠期或妊娠后女性中。剖腹产和高雌激素水平对该病可能具有促成作用,但有趣的是,如果一名女性在既往妊娠期间出现过硬纤维瘤且肿瘤已被切除,则未来妊娠期间该病复发的风险较低。研究显示,硬纤维瘤影响妊娠的风险极低,且妊娠过程可能是相对正常的,妊娠相关硬纤维瘤的总体结局较好。
现已证实硬纤维瘤还与既往创伤事件有关。高达 30% 的硬纤维瘤患者具有既往创伤病史,尤其是 FAP 患者中的手术创伤。一些研究表明,伤口愈合过程与间充质组织纤维增生性疾病存在分子关联,或许可以解释此种现象。
临床表现隐匿,影像学确诊困难
大多数硬纤维瘤表现为位于深处的无痛或疼痛程度极低的包块,并具有缓慢生长的病史。腹内硬纤维瘤可表现为肠梗阻、肠缺血或回肠肛管吻合功能退化(通常是因 FAP 接受过结肠切除术的患者)。
几乎身体任何部位都可发生硬纤维瘤,但以躯干/四肢、腹壁和腹内 (肠和肠系膜) 为主,乳房中发生硬纤维瘤较罕见。FAP 患者主要为腹内硬纤维瘤。在非 FAP 病例中,最常发生的部位为肩胛带、髋-臀区域和四肢。
硬纤维瘤可能在一个部位为多发性,但在同一患者体内很少发生于不同区域。硬纤维瘤一般不会发生转移,但却具有局部侵袭性,且即使在完全切除后仍具有较高的复发率。
CT、MRI 等影像学无法有效区分硬纤维瘤与恶性软组织肿瘤,应用 CT 可以对硬纤维瘤进行充分评估,但还是优先推荐 MRI 检查。硬纤维瘤的诊断只能通过组织活检,依靠免疫组化来进行确诊。
生物学特性
大多数硬纤维瘤随着时间而逐渐变大,但生长较为缓慢,且可有生长停滞或自然消退的现象。有研究报道,在疾病确诊后,最初并未接受手术、放射疗法或全身性治疗的患者,其 5 年无进展生存率为 50%,尚有约 20% 患者可自行消退。因此,有专家建议,该病在确诊后,如没有明确有效的治疗措施,可以选择观察为主。
不同分期的 5 年生存率均较高
硬纤维瘤既不会转移扩散,也不会恶变为纤维肉瘤,但具有局部浸润性,可通过破坏邻近重要结构和器官导致患者死亡。大多数中心报道,非发生于腹内的硬纤维瘤患者的死亡率低于 1%,而腹内硬纤维瘤常具有致命性,尤其是在具有 FAP 的情况下。
克利夫兰诊所曾提出了一个针对 FAP 相关硬纤维瘤的预后分层系统,不同分期的 5 年生存率如下:
Ⅰ期:无症状,最大直径<10 cm 且不生长——100% ;
Ⅱ期:轻度症状(有包块或疼痛,但生活不受限制),最大直径<10 cm 且不生长——100%;
Ⅲ期:中度症状(有包块、疼痛,生活受到限制但不住院),或肠/输尿管梗阻,或最大直径为 10~20 cm 或生长缓慢——90%;
Ⅳ期:严重症状(感觉到包块、疼痛,生活受到限制且住院),并发感染(如瘘管和脓肿),或最大直径 >20 cm 且生长迅速——70%。
原发性硬纤维瘤:部位不同,治疗策略有差异
1. 腹外和腹壁硬纤维瘤:若可使切缘阴性,仍推荐手术治疗
对于稳定、无症状的原发性硬纤维瘤,密切观察是一种可接受的策略,尤其是在手术切除会引起严重并发症时。
NCCN 指南建议,对于潜在可切除但没有症状、不危及生命且不会引起重大损害的硬纤维瘤患者,初始治疗可以观察为主;对于不可切除的肿瘤或手术可能导致炎症的并发症的患者,也可采取观察为主的策略。
如果技术上可行,可完整手术切除肿瘤,且可使切缘阴性,仍推荐手术治疗。对于手术切除后需要行脏器重建(如肠吻合、肠造瘘)的患者,鉴于硬纤维瘤有复发的倾向,重建时应考虑到未来再次进行切除和重建的可能性。
即使是手术完全切除后,硬纤维瘤的复发率也很高,且尚不明确手术切缘阳性对局部复发率的影响。此外,切除似乎不会影响患者的生存,因此,总体手术策略应在尽量保留功能的基础上进行完全切除,以尽量减少并发症。
对于不适合手术治疗、拒绝手术治疗和或手术并发症较多的硬纤维瘤患者,放疗是一种有效的初始治疗选择。若单纯行放疗,病变消退的时间通常较长,可能需要数年才能完全消退,但可使 70%~80% 的肿瘤得到较长期的局部控制。
对于确定性治疗,文献中推荐的放疗剂量为 50~60 Gy,持续 5~7 周,每次 1.8~2 Gy。因为使用更高剂量并不会降低局部复发率。没有证据支持在手术完全切除后进行辅助性放疗有额外的疗效,因此并不推荐。
硬纤维瘤的术前新辅助化疗方面的研究数据极少,仅个别案例中有报道此中方法是有效的,至少对进展期疾病有效。
2. 腹内硬纤维瘤:建议初始保守治疗
与腹外和腹壁硬纤维瘤相比,腹内硬纤维瘤几乎没有手术切除的可能,尤其 FAP 患者中的腹内硬纤维瘤通常是无法切除的,因为它们广泛浸润肠系膜且通常为多发性。尝试性切除会出现严重的并发症,包括肠缺血坏死,肠粘连及梗阻,以及瘘管形成。且尝试性切除后的复发率较高,复发后的肿瘤比初始肿瘤更具侵袭性。
美国结直肠外科医师协会以及美国临床肿瘤学会/肿瘤外科学会的一个联合工作组提倡,对于存在巨大、缓慢生长、累及肠系膜或包绕血管和/或器官的腹内硬纤维瘤的 Gardner 综合征患者,给予保守治疗而非初始切除术。保守的全身性治疗选择包括非细胞毒性疗法(NSAID、他莫昔芬)、放疗、伊马替尼靶向治疗或细胞毒化疗。
复发性硬纤维瘤的处理
对于大多数非腹内硬纤维瘤出现局部复发的患者,如果手术切除可行,则对于复发性腹外硬纤维瘤,仍首选手术切除。如果切缘阳性,现有的策略是推荐行术后放疗。约至少 78% 的复发患者行放疗后,可使肿瘤的进展得到局部控制。对于既往照射部位出现复发而补救性手术治疗不可能成功的患者,可应用全身疗法进行治疗。可以考虑应用细胞毒性和非细胞毒性药物进行治疗。
对于腹内硬纤维瘤复发的 FAP 患者,再次手术要非常慎重。因为随着每次手术的干预,肿瘤复发会更加频繁且更具侵袭性。因此,必须根据患者症状群和临床情况来个体化地确定最佳治疗。对于大多数此类患者,仍强烈推荐初始内科治疗。
小结
硬纤维瘤的治疗是一个临床难题,尤其是腹内硬纤维瘤合并 FAP 的患者。由于对该病缺乏足够的认识,手术切除的定式思维常常会给患者带来意想不到的伤害。对于该种情况,鉴于其局部侵袭性行为和复发时出现更具侵袭性病变的倾向,建议最好由专门从事肉瘤治疗的多学科组参与进行治疗策略的制定。
参考文献
[1] 李舒, 方志伟. 硬纤维瘤治疗研究进展. 中华肿瘤防治杂志,2010,17(17):1391-1395.
[2] De Camargo VP,keohan ML,D Adamo DR,et al.Clinical outcomes of systemic therapy for patients with deep fibromatosis(desmoid tumor).Cancer,2010,116(9):2258-2265.
[3] Fallen T,Wilson M,Morlan B,et al.Desmoid tumors-a characterization of patients seen at Mayo clinic 1976-1999.Fam Cancer,2006,6(2):191-194.
[4] Giardiello FM,Petersen GM,Piantadosi S,et al.APC gene mutations and extraintestinal phenotype of familial adenomatous poly posis.Gut,1997,40(4):521-525.
[5] Gurbuz AK, Giardiello FM, Petersen GM, et al. Desmoid tumours in familial adenomatous polyposis.Gut,1994,35(3):377-381.
[6] Lynch HT,Fitzgibbons R Jr.Surgery, desmoid tumors, and familial adenomatous polyposis: case report and literature review. Am J Gastroenterol,1996,91(12):2598-2601.
[7] Lewis JJ,Boland PJ,Leung DH, et al.The enigma of desmoid tumors.Ann Surg,1999, 229(6):866-872.
[8] Skubitz KM.Biology and treatment of aggressive fibromatosis or desmoid tumor.Mayo clin proc,2017,92(6):947-964.
[9] Penna C,Tiret E,Parc R,et al.Operation and abdominal desmoid tumors in familial adenomatous polyposis. Surg Gynecol Obstet,1993,177(3):263-268.
[10] Schlemmer M.Desmoid tumors and deep fibromatoses.Hematol Oncol Clin North Am,2005,19(3):565-571.
[11] Bonvalot S, Ternès N, Fiore M, et al. Spontaneous regression of primary abdominal wall desmoid tumors: more common than previously thought. Ann Surg Oncol ,2013,20(13):4096-4102.
[12] Quintini C, Ward G, Shatnawei A, et al. Mortality of intra-abdominal desmoid tumors in patients with familial adenomatous polyposis: a single center review of 154 patients. Ann Surg,2012,255(3):511-516.
[13] Azzarelli A, Gronchi A, Bertulli R, et al. Low-dose chemotherapy with methotrexate and vinblastine for patients with advanced aggressive fibromatosis. Cancer,2001,92(5):1259-1264.
[14] Fiore M,MacNeill A,Gronchi A,et al.Desmoid-type fibromatosis:evolving treatment standards.Surg oncol clin N Am,2016,25(4):803-826.
[15] Wilkinson MJ, Chan KE, Hayes AJ, et al. Surgical outcomes following resection for sporadic abdominal wall fibromatosis. Ann Surg Oncol ,2014, 21(7):2144-2149.
[16]Rodriguez-Bigas MA, Mahoney MC, Karakousis CP,et al. Desmoid tumors in patients with familial adenomatous polyposis.Cancer,1994,74(4):1270-1274.
[17] Smith AJ, Lewis JJ, Merchant NB, et al. Surgical management of intra-abdominal desmoid tumours. Br J Surg,2000,87(5):608-613.
[18] Guillem JG, Wood WC, Moley JF,et al.ASCO/SSO review of current role of risk-reducing surgery in common hereditary cancer syndromes.J Clin Oncol,2006,24(28):4642-4660.
本文作者:上海中医药大学附属龙华医院普外科 余奎
