大多数血管瘤较小,不需要治疗或者仅需长期随访,但是对于一些巨大肝血管瘤,由于其常引起不适症状,故须手术干预。而超巨大肝血管瘤(>20 cm)由于术中失血量大、术中止血困难或伴随血液、凝血系统异常,其手术干预过程仍存在许多技术挑战和风险。
为对超巨大肝血管瘤患者的病理特征进行描述并分享手术经验,来自中国中日友好医院的杨志英教授检索了巨大肝血管瘤患者的相关临床资料并对这些资料进行了分析,最终该研究结果报道在了 2016 年 12 月的 Surgery 杂志上。编者认为该研究对指导临床工作有很大的借鉴意义,故在此介绍。
第一部分:知识复习
在开始介绍该研究之前,请先通过以下几个问答来复习下肝血管瘤的相关知识。
1. 什么是肝血管瘤?
肝血管瘤是一种较为常见的肝脏良性肿瘤,临床上以海绵状血管瘤最多见,病人多无明显不适症状,常在 B 超检查或在腹部手术中发现。
其具体的病因尚不清楚,一部分学者认为血管瘤是由于胚胎发育过程中血管畸形所致,另一部分学者认为认为女性激素可能是血管瘤的一种致病因素,此外还有感染等学说。
2. 如何对肝血管瘤进行分类?
肝血管瘤可按病理进行分类,亦可按照大小进行分类,但由于按照大小分类对于选择合适的治疗方式具有指导意义,因此今天主要介绍这种分类方法,如下:
(1)小血管瘤<5 cm;(2)血管瘤 5~10 cm;(3)巨大血管瘤 10 cm~15 cm;(4)特大血管瘤>15 cm。
需注意,目前对于定义肝巨大血管瘤存在争议,有学者认为肝血管瘤>5 cm 应定义为巨大血管瘤,但是一部分学者却认为应该将血管瘤>10 cm 定义为巨大肝血管瘤。
与此同时,过去相关学者认为肝血管瘤>10 cm 应作为手术指征,但近年的相关文献证实这种观点存在局限性,对于巨大肝血管瘤是否选择手术治疗取决于其生物学行为、可能带来的临床症状、并发症以及患者的病情转归,而血管瘤大小本身不是手术治疗的决定性因素。
3. 那么肝血管瘤进行如何治疗?都有哪些治疗方式?
(1)非手术治疗指征
对于无症状的肝血管瘤且直径<5 cm 的患者,保守观察是安全的,对该类患者可定期行 B 超检查监测瘤体大小变化。
(2)非手术治疗措施
①射频消融:
采用预先毁损血管瘤主要供血区的方法,尽可能彻底损毁血管瘤,减少病灶残留。研究显示射频消融可用于治疗肝血管瘤,对于 10 cm 以上的巨大肝血管瘤,射频消融需 2 次或多次治疗以期达到病灶完全毁损,相比较腹腔镜手术,该方法手术创伤较小。
②微波消融:
B 超引导下经皮或腹腔镜下冷循环微波消融作为消融的另一种形式,亦可用于治疗肝血管瘤。
③介入栓塞:
经导管动脉栓塞是治疗症状性肝血管瘤的有效方法,特别是对于血供丰富的肝血管瘤,应用较多的是平阳霉素+碘化油乳剂行肝血管瘤栓塞,具有强大的末梢血管硬化作用。
其他方法包括平阳霉素+明胶海绵栓塞治疗、瘤体内灌注硬化剂加供血动脉阻断,均可使肝血管瘤有不同程度缩小、消失,无严重并发症发生。
④放射性治疗:
一些研究显示肝血管瘤可获益于放疗。
⑤药物治疗:
现已证实普萘洛尔的确切疗效,但相关报道证实索拉菲尼对于缩小血管瘤亦有一定疗效。
(3)手术治疗指征(2015 年我国肝血管瘤诊治共识)
①任何分型的肝血管瘤合并自发破裂出血或意外情况、有明确肝包膜下或腹腔大量出血伴失血性休克;
②有明显临床症状,如腹痛、腹部肿块或合并消耗性凝血病(血管瘤-血小板减少综合征);
③伴包膜下大血管瘤的计划怀孕妇女,建议行预防性手术切除,可避免孕期血管瘤破裂出血风险;
④急症需紧急处理的救命处置;
⑤无法区别良恶性的病变,特别是合并乙型肝炎和肝硬变者;
⑥对于无症状但强烈要求手术治疗的患者仍不推荐手术;
⑦虽然过去认为血管瘤体直径>10 cm 需作为手术指征,但目前认为还需要结合症状以及血管瘤位置等因素;
⑧血管瘤体直径 5~10 cm 但位于肝脏边缘且有发生外伤性破裂危险者;
(4)手术治疗措施
与非手术治疗方式相比,手术治疗效果可靠,可完整切除肿瘤,仍然是达手术指征的肝血管瘤的首选治疗方式。
主要包括:血管瘤剥除术、解剖性肝切除术(包括不规则切除、联合肝段或半肝段及扩大肝切除术)、肿瘤侧肝动脉结扎术等。
4. 手术治疗 EGH 都需要面对那些风险?
(1)术中失血量大和术中止血困难。
(2)EGH 常合并血液系统异常(白细胞减少症、贫血以及血小板减少)、凝血功能异常(低纤维蛋白原血症、凝血酶原时间延迟)以及肝功能异常。
(3)超巨大肝血管瘤对周围组织血管的压迫也增加手术困难和手术风险。
第二部分:研究介绍
1. 研究概述
研究者通过检索数据库搜集接受外科手术治疗巨大肝血瘤的患者,检索时间设定为 2010 年 1 月至 2016 年 1 月。收集人口统计学资料、肝血管瘤的相关特征、影像学特征、实验室资料、手术方式、术中变量、并发症率和死亡率。
根据肝血管瘤的大小,将入选患者分为超巨大肝血管瘤组(>20 cm,EGH)和巨大肝血管瘤组(>10 cm 但<20 cm,GH),分别比较两组患者的相关临床资料有无差异。对于 EGH 组,还需比较完整切除和仅局部摘除两种情况下的长期疗效差异。
根据 Clavien-Dindo 分类标准对术后并发症进行记录概括。术后随访时间 6 个月,包括临床检查、实验室检查以及肝脏超声。症状缓解分为五类:完全缓解、改善、加重以及持续。
2. 主要结果
共 141 位患者接受手术治疗巨大肝血管瘤,EGH 组 36 例患者,GH 组 105 例患者。所有患者中,最常见的症状是腹胀(70.9%),其次是腹痛(19.9%),EGH 组患者比 GH 组患者更容易发生腹痛,且 EGH 组患者卡萨巴赫-梅里特综合征发生比例更高。
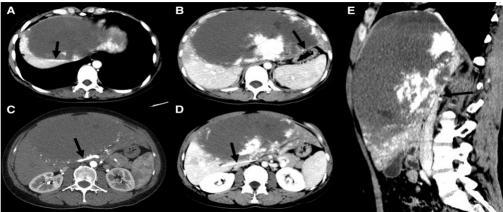
图 1 一位女性 EGH 患者的增强 CT 图像;图 A. 箭头所示为肝静脉;图 B. 箭头所示为胃出口;图 C. 箭头所示为肝动脉;图 D. 箭头所示为门静脉
这 141 位患者中,43 位患者(30.5%)为外生型肝血管瘤,这些患者中 33 位患者因肝血管瘤而存在胃出口压迫,相比较 GH 组,EGH 组肝静脉、肝动脉以及肝门静脉压迫率更高。
就手术而言,GH 组共 69 位患者和 EGH 组 15 例患者接受了血管瘤局部摘除术,GH 组 36 位患者和 EGH 组 21 例患者接受肝脏切除,GH 组 30 例患者和 EGH 组 1 例患者接受多病灶切除。
相比于 GH 组,EGH 组手术时间更短。
从数值上来看, EGH 组患者阻断时间明显更长,但从统计学分析上,两组在肝门阻断方面未得出显著差异。
EGH 组术中失血更多,且该组自体输血比例更高。
另外,EGH 组并发症率更高,但两组之间在死亡率方面却没有明显差异。
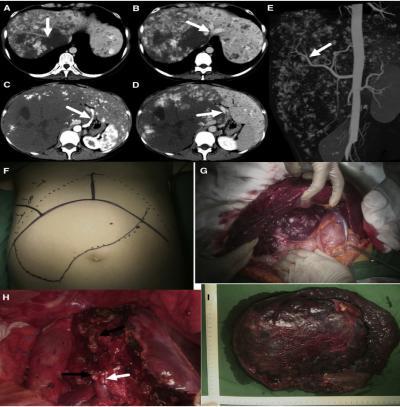
图 2 一例 EGH 患者,血管瘤位于右叶肝且合并卡萨巴赫-梅里特综合征,该患接受右半肝切除;图 A. 增强 CT 示被血管瘤压迫右肝静脉的(箭头);图 B 箭头. 病变压迫肝中静脉(箭头);图 C. 肝动脉(箭头);图 D. 门静脉;图 E.CT 造影结果示病变主要受右肝动脉供应;图 F. 术前检查示病变下缘远低于脐,计划行双肋下切口并有可能向右胸部延长;图 G. 术中图像;图 H. 切除后的肝表面,白色箭头示右侧动脉根部,黑色箭头示右侧门静脉根部;图 I. 肝血管瘤标本
3. 讨论分析
卡萨巴赫-梅里特综合征是以巨大血管瘤伴发血小板减少和全身出血倾向为特征的一种综合症。在以往报道中,虽然也有少数卡萨巴赫-梅里特综合征同时肝血管瘤小于 20 cm 的报道,但是大多数卡萨巴赫-梅里特综合征均为 EGH。另外,在以往报道中,EGH 往往引起血液系统和凝血系统的异常,这与本研究一致。
该研究中,所有大于 10 cm 的肝血管瘤患者中,30.5% 的患者接受手术治疗,23.4% 的患者存在胃出口压迫,这是导致患者腹胀不适或者患者餐后过早饱腹感的原因。由于肝左外叶与胃在解剖上极为相近,因此左侧肝血管瘤更可能引起餐后过早饱腹感。
腹痛患者在 EGH 组的比率明显高于 GH 组,这可能是因为 EGH 组患者肝包膜张力过大所致。研究结果亦显示 EGH 患者血管压迫率明显更高,手术时间、术中失血、输血发生率在 EGH 组明显高于 GH 组,这些对于手术干预来讲都是一些极为不利的因素。
尽管手术风险巨大,但是这 141 例患者中并未有严重的死亡率和并发症率,尽管相关并发症率在 EGH 组较高,但是术后结局 EGH 组和 GH 组并无明显差异。
在手术方式的选择方面,虽然有些学者提倡血管瘤局部摘除,但结合本研究结果,相比较肝脏切除组,局部摘除组肝门血流阻断率更高,这一点值得临床作为参考。
研究者认为,EGH 可以引起血液系统或者凝血系统异常,并且可能压迫周围血管,增加手术风险,但是手术仍可安全进行,包括合并卡萨巴赫-梅里特综合征的患者。
参考文献
1.Xiaolei Liu, Zhiying Yang, Haidong Tan,et al. Characteristics and operative treatment of extremely giant liver hemangioma >20 cm. Surgery. 2017 Jun;161(6):1514-1524.
2.肖震宇,杨藩,龙新,等. 冷循环微波消融治疗肝血管瘤 120 例 [J]. 中国微创外科杂志,2012,12(10):901-903.
3.康振, 肖恩华. 肝血管瘤的治疗进展[J]. 实用医学杂志. 2014. 30(23):3729-3731.
4.毛一雷, 徐威. 肝血管瘤手术指征的转变与探讨, 2016. 23(2):134-136.
