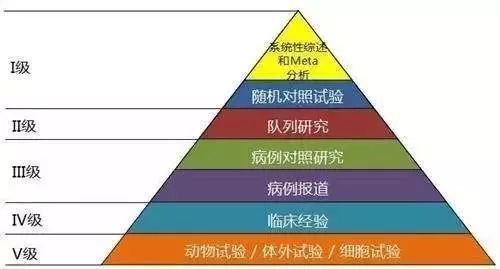
近些年,学术界讨论最热的话题之一就是-真实世界研究(Real-World Study,以下简称 RWS)!但 RWS 并非新产生的研究类型,为何突然成为焦点?而 RWS 和常见的随机对照研究(RCT),各有何特点?
随机对照研究
过去 70 年,RCT 重塑了医学知识和临床实践。RCT 以其对无关变量的控制、极其标准化的结果生成形式和专业化人员的持续监察,在产生科学证据方面拥有巨大优势。然而,过去七十年也见证了这一「金标准」存在很多局限性。
(一)随机对照研究的历史
在 19 世纪晚期,随着临床医学对科学的重视,医生在临床研究中越来越严谨。20 世纪早期,一些革新者推出了许多临床试验方法来消除偏倚,其中包括设盲,交替分配到试验组,以及统计分析。
20 世纪 40 年代,英国的流行病学家奥斯汀·布拉德福德·希尔(Austin Bradford Hill, 1897~1991 年)在研究治疗肺结核疗法的时候,提出了随机双盲对比试验的原则。
在 50 年代,他和理查德·多尔(Richard Doll, 1912~2005 年)建立起很多随机对照的早期研究方法。例如,他们给英国所有的医生写信,询问他们生活的各个方面,包括他们的吸烟习惯。当时很多医生都吸烟,通常还吸很多,并不认为这种高度成瘾的行为会有什么特别的风险。
在接下来的很多年,他们追踪了 4 万名男医生,并且很快发现重度吸烟者发生肺癌的风险要明显高于非吸烟者。如果停止吸烟,肺癌的死亡率就会降下来,尽管其死亡率依然高于那些终生不吸烟的人。因而,他们第一次找到了一种可以预防癌症的方式。
上世纪 50、60 年代,对于随机对照试验的支持是较弱的。药品生产企业不愿投入资源和时间进行随机对照试验,终于在 1961 年造成了严重的悲剧,曾被提供给成千上万个孕妇的沙利度胺,后被确认为是当时在国际上引起大量死胎和短肢畸形儿出生的罪魁祸首。作为对此事的回应,美国国会在 1962 年颁布了针对食品,药品及化妆品法案的 Kefauver–Harris 修正案,强制要求新的药物需在「充足严格的对照研究」下被证明是有效的。到 1970 年,美国食品和药物管理局(FDA)以要求新药批准必须经过随机对照试验来实现修正案的实施。
欧洲经济共同体委员会,日本政府和许多国家的监管机构相继实施了类似的法规。随着时间的推移,各国监管机构合作制定了临床研究的国际标准,进一步系统化了随机对照试验。为了在竞争日益激烈的市场获得监管部门对新药的用药指征的批准,医药行业反而成为随机对照试验的主要赞助商。到了 80 年代初,医学家们称随机对照试验为医学知识金标准。到了 90 年代,医药厂家已经取代政府和医学学术机构,成为随机对照试验的推动者。
(二)随机对照研究存在的问题
然而,随机对照研究并没有垄断医学知识的生产。观察研究的新方法不断涌现——例如,使用患者的大数据库,对于那些在常规治疗模式下相对有效的治疗结果进行比较效果的研究,产生比较效果数据(以此选出最佳治疗方案)。除了经验数据,医生继续依靠生理机制进行研究。冠状动脉腔内成形术和随后的支架治疗的崛起,并不是基于随机对照研究,而是通过技术的直觉逻辑和血管造影提供的令人信服的视觉证据。
过去三、四十年间,随着越来越多的手术随机对照试验出现,医生也逐渐认识到其局限性:每个患者具有独特的病理结果,每个医生有不同的技能,每个手术涉及无数种的麻醉选择、术前用药、手术方法、仪器仪表及术后护理,而所有这些都和临床试验所需的标准化相违背。假对照组因不能被用于主要手术,导致了对设盲实验的限制。曾在 CABG 发展起到关键作用的知名外科医生 René Favaloro 就认为随机对照试验不适用于手术,并指出「随机对照试验已经获得如此高的科学地位并被广泛接受,它被给予一种近乎宗教的圣洁…,如果完全依赖随机对照试验可能是危险的。」
哪怕是一些比较成功的随机对照试验也不能影响临床实践。美国政府资助的 ALLHAT(抗高血压和降脂治疗预防心脏病发作试验)表明,一般的噻嗪类利尿剂和那些较新的、昂贵的钙通道阻滞剂和血管紧张素转换酶抑制剂在治疗高血压方面同样有效。然而这些结果被药品生产方和多疑的临床医师提出质疑,导致新型抗高血压药物销售增长速度远高于利尿剂。
从科学的角度来说,RCT 通过一系列入选排除标准选取一定样本的特定人群,无法确定在真实临床实践中的可推广性,另外出于控制变量的设计,RCT 很少获得关于伴随疾病和伴随治疗的信息,并且为了依从研究方案往往采取较多的干预措施,这在临床实践中也不太现实。相当多的证据表明,医疗企业资助的试验比公共资金资助的试验更可能产生正面的结果。此外,到了 90 年代,正面结果的发表比负面结果多得多,这损害了医学知识。
随着时间的推移,随机对照研究变得非常官僚,需要用昂贵的基础设施来进行研究设计,病人护理,记录保存,伦理审查及统计分析。到了 21 世纪,一个单项的 RCT 研究可能要花费 3 千万美元甚至更多。
真实世界研究(Real-World Study,RWS)
(一)RWS 的特点
RWS 是起源于实用性的临床试验,是从传统临床科研以外的多个数据集中挖掘出的信息,采取非随机、开放性、不使用安慰剂的研究。RWS 的形式包括观察性队列、登记和管理型数据库。
RWS 具有以下特点:研究的实施地点以及干预条件为真实的临床实践环境;受试者的选择一般不加特别的限制条件;干预措施和临床实际一样,并可由患者和医师进行交流而改变干预方法。RWS 的来源相当广泛,可以包括电子病历、医保数据库、电子设备和 app、患者登记项目,甚至社交媒体。FDA 认为,这些资源的合理使用可以产生一些新的价值;研究的结论可直接推之于临床实践。
真实世界研究不仅可以减少传统研究的限制,而且还可以反映真实世界中治疗药物的临床疗效,为临床选择使用新药及新型设备提供客观的对比依据。通过真实世界数据,可充分了解指南与实践的差距,为指南的制定与规范提供参考,而且还能平衡临床疗效和成本效益。

(二)RWS 的「窘境」
此外,不经过严格的知情同意也会带来数据隐私暴露的风险。
(三)美国国会批准新药审批可利用「真实世界证据」
2016 年 12 月,美国国会在官方网站上公布了《21 世纪治愈法案(21st Century Cures Act)》(以下简称 21 世纪法案)最终版本。而法案中关于利用「真实世界证据」取代传统临床试验进行扩大适应症的批准,更是牵动了业界的神经,对此,业内人士认为会加快药品获批速度,但也担忧这降低了审评的科学性,预示着不良趋势的开端,甚至认为是好不容易建立起来的科学审评的倒退,简直是重回到了 20 世纪以前。为此,FDA 在《新英格兰医学》发文,意在澄清两个问题:一是真实世界证据(Real-World Evidence,以下简称 RWE)并不等于不采用干预性试验和随机化的试验设计;二是 RWE 用于审批仍要遵循严格的科学基础。
(四)大数据将助力 RWS
或许未来我们可以看到,通过大数据是可以助力真实世界研究的,因为大数据能帮 RWS 充分掌握研究背景 ,提出有创新性的研究设想和完善的研究设计。对于数据的分析可以采用一体化的数据管理模式,避免原始数据的错误,提高数据处理效率和准确性。定制临床研究云平台,加强研究者项目管理水平,通过各方合作提高科研效率,实现数据的实时化、标准化和格式化。
本文根据「高原译:审视金标准——从随机对照试验的历史中得到的经验教训」、生物探索网等相关文章整理而成。
本文由「鲁原心论坛」微信公众号授权发布
封面图来自 vecteezy
编辑|刘敏 辛也
扫描下方二维码关注「丁香智汇」,阅读更多精彩文章!