北京时间 11 月 9 日 19 时许,辉瑞和 BioNTech 在对外公布了他们联合研制的新冠候选疫苗 BNT162b2 在 III 期临床试验的早期有效性数据经数据审查委员会中期分析的结果。

图源:辉瑞官网
尽管目前这个结果相对仓促,但其中不乏亮点:通过评估 94 例病例,疫苗表现良好,保护效力超过 90%。
这是全球首款公布有效性的新冠候选疫苗。
Nature 随后也立即发文,回应了这款疫苗的好消息,同时对安全性和免疫效力的持续时间提出了关注。

图源:Nature
90% 保护效力要怎么理解?
为什么要等待 164 个病例?
BioNTech 的 CEO Ugur Sahin 表示,此前研究人员预计疫苗的有效性会仅在 60~70% 之间,因此有效性超过 90% 出乎所有人意料。
辉瑞的 III 期临床试验共纳入了 43538 名志愿者,目前共发生了 94 例感染。根据该试验计划,该实验在达到 164 例感染的时将进行最终的数据分析。
辉瑞的 CEO Albert Bourla 称:根据辉瑞公司与美国 FDA 的协定,辉瑞将选取 62 名病例进行中期数据分析,但最终选取了 94 个病例。
Ugur Sahin 表示:「我们目前需要等待,直到搜集到 164 个病例,获取疫苗的更多数据,更全面地分析疫苗的保护力,根据这个试验原本的设计来完成它。」
为什么要等待 164 个病例?
一般来说,这个数字的制定,一方面是循证医学对数据的要求,另一方面是结合了全球各地对疫苗试验的审查及相关规定、新冠肺炎感染的死亡率等因素,统计出完成试验的所需最小病例数。
本次试验目前没有发生严重不良反应,但辉瑞称后续将继续收集有关安全性的数据。
若该疫苗完全达到安全性和有效性的要求,辉瑞和 BioNTech 就计划向美国 FDA 提交紧急使用授权,目前该计划预计将在 11 月的第三周(下周)进行。
据辉瑞官网信息,辉瑞和 BioNTech 预计今年可以生产 5000 万剂次,2021 年可以生产 13 亿剂次。
据美媒报道,辉瑞 CEO Albert Bourla 在采访中称该疫苗将免费发放给美国居民。 疫苗的高能表现和辉瑞 CEO 免费发放的承诺,预期带动「线下业态」全面重启。今日由辉瑞疫苗引发的众多消息直接带来了股市的小高潮,辉瑞公司、美国四大航空、酒店业、旅游业的股票暴涨。
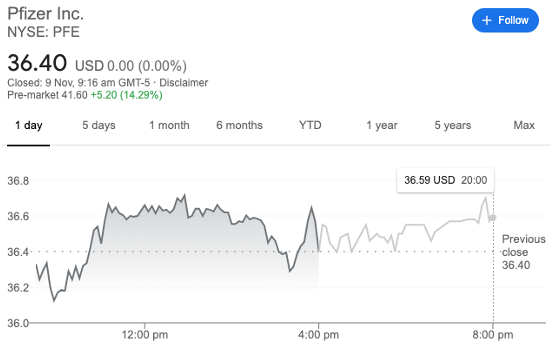
图源:网络
倘若辉瑞的疫苗能够最终抢先上市,这将成为人类历史上第一款上市的冠状病毒疫苗,也是第一款上市的核酸(mRNA)疫苗,这无疑将在疫苗领域掀起一场新的疫苗风潮。
mRNA 疫苗技术的前世今生
同样使用 mRNA 疫苗技术的 ModeRNA 公司,研制了一款代号为 mRNA-1273 的新冠疫苗。3 月 16 日,ModeRNA 这款疫苗在美国西雅图市完成了第一针注射,成为了全球第一例新冠疫苗人体试验。
而昨天,辉瑞抢先发布中期有效性分析结果。
mRNA 疫苗到底是怎样的一种技术?
mRNA(信使 RNA),是细胞内翻译蛋白质的单链核糖核酸。
在确定新冠病毒病原体仅仅 4 天后,我国科学家就将新冠病毒基因组全序列向全世界公布。而公布序列的 3 天后,美国国家过敏与传染病研究所(NIAID)的 Barney Graham 就计算出了疫苗的最佳靶点——棘突蛋白(Spike Protein)。
正是由于这两个史无前例的速度,使得 mRNA 疫苗的研发进度飞快。
研究人员通过已公布的新冠病毒 RNA 序列,就可以直接对翻译靶点蛋白的 RNA 片段进行修饰和编辑(例如:辉瑞采用了 1-甲基-假尿苷修饰的方法),获得一段可以产生抗原蛋白的 RNA 片段。这段 RNA 注射到体内后,人体的体细胞自身产生大量的抗原蛋白,从而引起特异性的免疫反应。

图源:BioNTech 2020/4 BNT162 最新进展
理论上来说,这种方法可以让人体产生抵抗力。进入人体的 mRNA 能够进一步指导抗原蛋白的翻译,指导完成后在体内降解。但理论毕竟是理论,mRNA 疫苗技术早在上世纪 90 年代就已经出现,之所以一直未取代传统疫苗工艺,是因为它非常受制于技术、mRNA 本身性质等诸多因素。
普通疫苗(灭活病毒或抗原蛋白等)一般比较稳定,可以通过静脉注射的方式到达体内,但 mRNA 本身非常不稳定,容易降解。
辉瑞利用脂质体包埋的技术将 mRNA 制成纳米颗粒,将疫苗「伪装」成病毒。注射后,疫苗通过胞吞的方式进入细胞,在细胞内释放出纳米颗粒内的 mRNA,从而发挥 mRNA 的作用。这样一来就能解决了 mRNA 进入人体后会快速降解的问题。从目前公布的 I/II 期临床试验的结果来看,这个方案已经获得了数据上的支持。
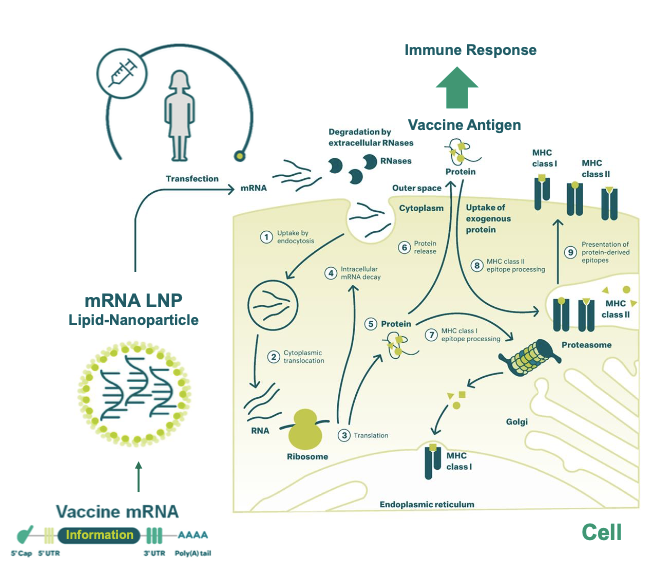
图源:BioNTech 2020/4 BNT162 最新进展
6 月 25 日,军科院和云南沃森生物合作研发的新冠疫苗 ARCoV 正式进入临床试验,成为我国首个新冠 mRNA 疫苗。这款疫苗目前处于临床 I 期试验中。
辉瑞的 mRNA 疫苗安全吗?
mRNA 疫苗有许多优点。疫苗本身并不像活病毒疫苗一样具有传染性,产能大,制作流程比灭活病毒来的简单,成本相对便宜。
但由于从未在任何一种被批准的药物中使用过,mRNA 疫苗的安全性和有效性一直备受瞩目。
我们先来回顾一下辉瑞的 I/II 期临床试验的结果。
辉瑞疫苗 I/II 期试验于 2020 年 5 月开始。
试验共纳入了 45 人,平均分为 3 组,各组内的 15 人再分 12 人接种疫苗,另外 3 人接种安慰剂。接种疫苗的三组的志愿者分别接种低剂量疫苗(2 针)、中剂量疫苗(2 针)和高剂量疫苗(1 针)。
试验中最常见的不良反应是注射部位疼痛。在低剂量组中,58.3% 的志愿者反映了注射部位的疼痛,而在中剂量和高剂量组中,这个比例则高达 100%。其中,高剂量组的一名志愿者反映了注射部位的剧烈疼痛。除此之外,接种疫苗后的局部反应都是轻中度的。
常见的全身性不良反应包括轻中度的疲劳和头痛,其他全身性的不良反应还包括寒颤、肌肉及关节的疼痛等。
值得注意的是,在各剂量组中,接种疫苗的志愿者不良反应的发生率均高于对照的安慰剂组。另外,随着剂量的增加,不良反应的发生率也有所增多。
接种第一针后,低、中剂量组各有一人(8.3%)出现发热,而高剂量组则有一半的人(50%)出现发热。接种第二针后,低剂量组仍有一人(8.3%)发热,而中剂量组中这个数字跃升至9人(75%)。
这些局部或全身性的副作用都在注射后的第二天达到高峰,但都能在一周内自行缓解。

图源:参考资料 2
低、中剂量组中各有 6 人(50%)出现较严重的不良反应,高剂量组中有 7 人(58.3%)有严重不良反应。这些不良反应包括接种 2 天后出现的高烧和睡眠质量严重下降。
低、中、高剂量组分别有 1 人(8.3%)、5 人(45.5%)和 6 人(50%)在注射疫苗后,发现白细胞计数降低的情况,三组中各有 1 人白细胞计数下降幅度较大,但所有志愿者在 6~8 天后白细胞计数均能恢复到正常范围。
研究人员认为,白细胞计数的下降并没有造成临床症状出现。而 mRNA 疫苗可以诱导干扰素的产生,这可能导致了白细胞往组织的迁移,从而造成了白细胞数值的变化。
注射后,三个疫苗组的志愿者都能在首次注射就产生新冠病毒的抗体。在低、中剂量组志愿者接种第二针后,抗体的滴度会再次上升。另外,志愿者体内能够测得 T 细胞产生的免疫应答。
和其他技术路线疫苗横向对比,从目前几款完成了 II 期试验疫苗所公布的试验数据来看,不论技术路线是怎样的,所有新冠候选疫苗都能诱导出强烈的免疫应答,不良反应都在可控范围内,也都没有出现非常严重的不良反应。(阿斯利康和强生曾因为出现严重不良反应暂停试验,目前已恢复试验。详见:刚刚!阿斯利康新冠疫苗恢复 III 期试验,此前因疑似严重不良反应叫停)
具体来看,虽然 mRNA 疫苗的中和抗体滴度优于灭活疫苗及腺病毒载体疫苗,但 mRNA 疫苗的不良反应发生率比另外两款疫苗都高。
这可能说明了,mRNA 疫苗所激发的免疫反应更为强烈,但也同时导致了更多不良反应的发生。但具体是不是这个原因,还有待通过 mRNA 疫苗进一步的试验数据来完成相关研究。
此外,Nature 昨夜的文章还提到,目前辉瑞疫苗呈现出的结果并不能回答所有的问题。
宾夕法尼亚大学的疫苗学家 Paul Offit 说:「如果安慰剂组中出现了若干例重症的新冠感染者,那么更能表明疫苗预防的有效性。」
纽约市西奈山医学院的病毒学家 Florian Krammer 同时提到:目前疫苗虽然颇有成效,但仍然无法证明它能阻断病毒人与人之间的传播。而且,目前辉瑞所搜集的病例数比较少,还不能看出这款疫苗是否在不同人群间都能起到该有的保护效力。
目前全球新冠疫苗的进度
截至 11 月 10 日,根据 WHO 官网公布的消息,全球共有 47 款新冠病毒候选疫苗进入临床试验阶段,较上次 WHO 公布数据新增 2 款。
进入 III 期试验的为 10 款,其中中国 4 款(康希诺、国药北京和武汉、科兴)、英国 1 款(阿斯利康)、美国 4 款(辉瑞、ModeRNA、强生、Novavax)、俄罗斯 1 款(伽玛利亚)。
另外,印度 Bharat 公司官方社交媒体称其疫苗的 III 期试验已获批,而 WHO 所公布的信息中,仍显示其 III 期试验暂未开展。
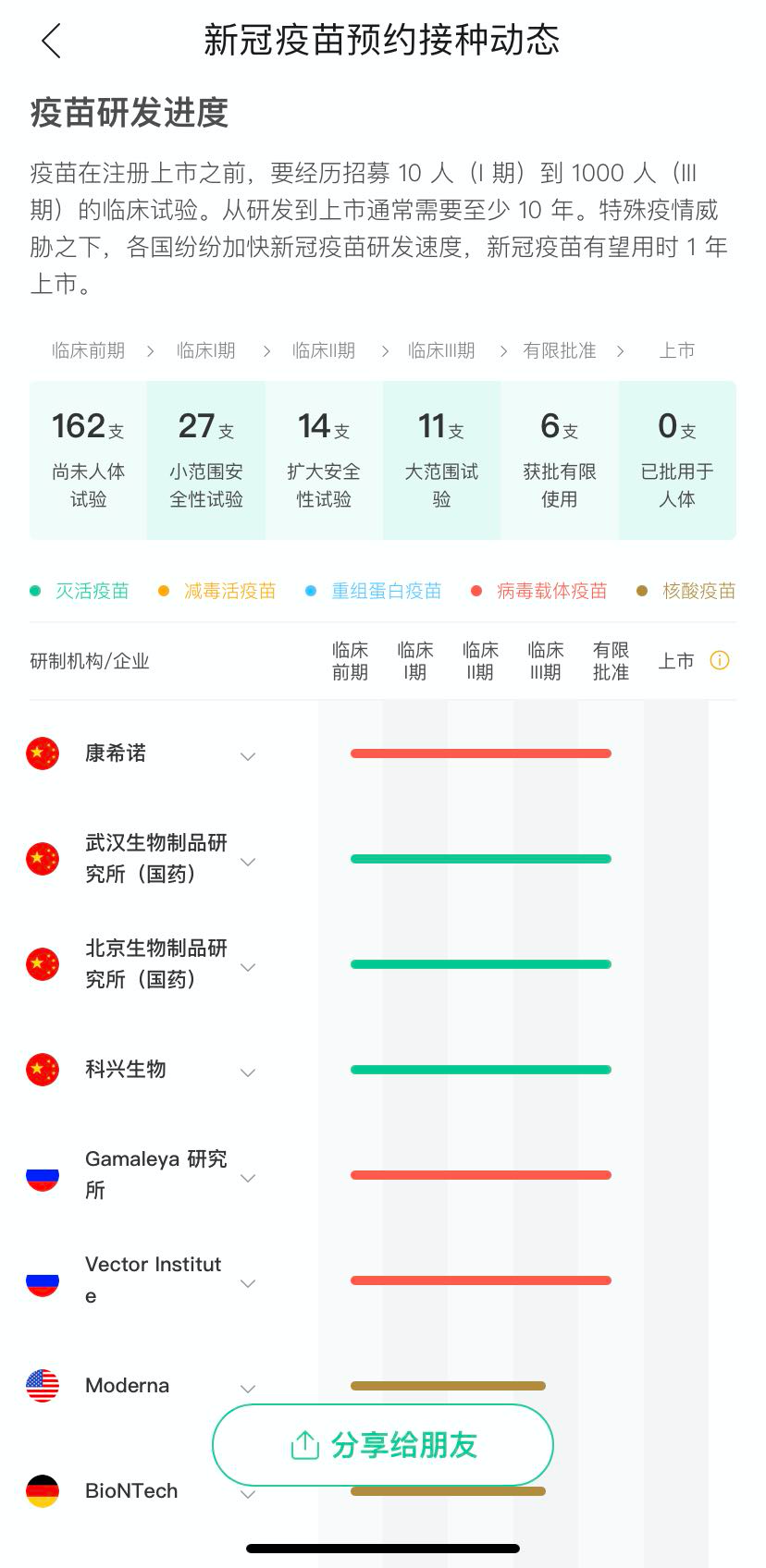
图源:来问丁香医生
总体来看,在当前人类与疫情的对抗中,辉瑞的这项结果给我们带来了新的希望。但也正因为这还是一项早期有效性数据,都还需要更长的时间来验证。
就像庞麦郎在歌里唱的,只有时间才能给我们答案。(审核:gyouza)
致谢:本文经 北京生物制品研究会会员、知名健康博主 卤煮疫苗 专业审核
题图来源:图虫创意
参考资料:
1)
https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
2)Mulligan, M.J., Lyke, K.E., Kitchin, N. et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature 586, 589–593 (2020).
3)Sahin, U., Muik, A., Derhovanessian, E. et al. COVID-19 vaccine BNT162b1 elicits human antibody and TH1 T cell responses. Nature 586, 594–599 (2020).
4)
https://www.pei.de/SharedDocs/Downloads/EN/newsroom-en/dossiers/ppt-erste-studie-sars-cov-2-impfstoff-en.pdf?__blob=publicationFile&v=7
5)https://www.nature.com/articles/d41586-020-03166-8
6)
https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines
